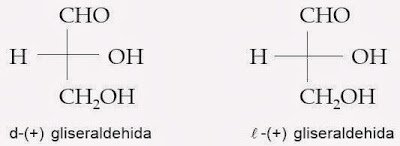Stereokimia merupakan sebuah subdisiplin kimia, melibatkan studi tentang penataan ruang relatif atom yang membentuk struktur molekul dan manipulasi mereka. Cabang penting dari stereokimia adalah studi tentang molekul kiral.
A. konfigurasi mutlak
Sampai tahun 1956, konfigurasi mutlak tidak ada senyawa optik aktif dikenal. Sebaliknya, konfigurasi ditugaskan relatif terhadap standar, gliseraldehida., Yang awalnya dipilih oleh E. Fischer (sekitar 1885) untuk tujuan menghubungkan konfigurasi karbohidrat. Fischer sewenang-wenang ditugaskan 3a konfigurasi untuk dekstrorotatori gliseraldehida, yang dikenal sebagai D - (+) - gliseraldehida. The levorotatory enansiomer, 3b, ditunjuk sebagai L - (-) - gliseraldehida. (Jika Anda tidak yakin tentang terminologi D dan L, atau aturan untuk menulis Fischer rumus proyeksi, ulasan Bagian 5-3C dan 5-4.)
Susunan keruangan keempat gugus yang terikat pada pusat kiral disebut Konfigurasi Mutlak, yang dinyatakan dengan konfigurasi R/S. Penentuan konfigurasi R/S molekul kiral pada umumnya didasrkan sistem perioritas yang dikembangkan oleh Cahn-Ingold-Prelog. Penentuan dengan metode ini memerlukan daya nalar keruangan atau gugus-gugus di sekitar pusa kiral yang dinyatkan dalam struktur 3 dimensi. Penentuan konfigurasi R/S dengan kaidah tangan kanan merupakan penetuan konfigurasi R/S yang merupakan metode yang dikembangkan oleh Cahn-Ingold-Prelog. Di samping itu ada metode penentuan konfigurasi R/S dengan aturan perkalian. Metode yang disebutkan terakhir tidak menuntuk daya nalar keruangan.
Penetapan Konfigurasi Sistem ( R ) atau( S )
· Bayangkan molekul dalam bentuk 3D, putarmolekul hingga gugus berprioritas rendahberada di belakang.
· Gambar panah dari gugus berprioritas palingtinggi ke rendah.
· Searah jarum jam = (R ), berlawanan jarum jam = (S) =>
Konfigurasi mutlak ditentukan berdasarkan struktur penataan ruang gugus-gugus di seputar karbon kiral sesungguhnya.Cara penentuan konfigurasi absolut dikemukakan oleh tiga orang ahli kimia yaitu R.S. Chan (Inggris), C.K. Ingold (Inggris) dan V. Pulog (Swis). Cara penamaan/penentuan konfigurasi absolut yang mereka kemukakan dikenal dengan sistem R/S atau sistem Chan-Ingold-Pulog (CIP). Huruf R dan S merupakan singkatan kata berasal dari bahasa Latin, yaitu R = rectus, artinya kanan dan S = sinister, artinya kiri.Dalam menentukan konfigurasi absolut sistem R/S ini, Chan-Ingold-Pulog menetapkan gugus-gugus yang terikat pada suatu pusat kiral dengan prioritas berbeda-beda. Cara penentuan prioritas untuk atom/gugus yang terikat pada pusat kiral adalah serupa dengan urutan prioritas gugus untuk menentukan isomeri E-Z.
Sebagai contoh cara penentuan konfigurasi absolut, perhatikan konfigurasi
absolut pada senyawa (1) dan (2) berikut. Kedua senyawa tersebut merupakan
pasangan enantiomer bromo-fluoro-kloro metana.
- Urutkan prioritas keempat atom yang terikat pada pusat kiral berdasarkan nomor atomnya. Diketahui nomor atom Br = 35, Cl = 17, F = 9, H = 1, maka urutan prioritas keempat atom di atas adalah Br > Cl > F > H.
- Gambarkan proyeksi molekul sedemikian rupa hingga atom dengan prioritas terendah ada di belakang atau putar struktur (1) dan (2) sehingga atom H ada di belakang.
- Buat anak panah mulai dari atom/gugus berprioritas paling tinggi ke prioritas yang lebih rendah.
- Bila arah anak panah searah jarum jam, konfigurasinya adalah R. Bila arah anak panah berlawanan dengan arah jarum jam, konfigurasinya adalah S. Jadi konfigurasi struktur (1) adalah S, sedangkan konfigurasi struktur (2) adalah R.
B. Konfigurasi Relatif
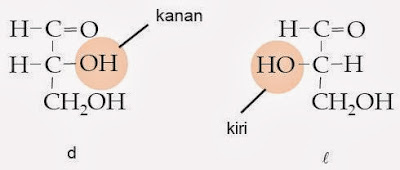
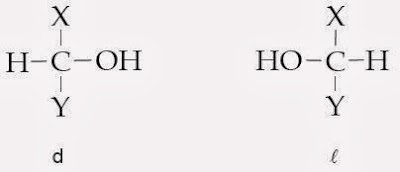
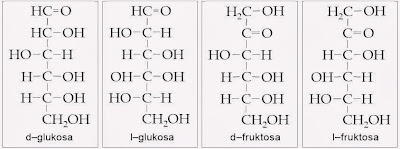
Konfigurasi relatif muncul sebelum struktur penataan ruang gugus-gugus di seputar karbon kiral sesungguhnya diketahui. Karena belum diketahui itulah, konfigurasi ditentukan dengan cara membandingkan dengan suatu standar, jadi disebut konfigurasi relatif.Dalam rumus Fischer digunakan istilah dekstro (d) dan levo ( l ). Biasanya huruf d atau lditulis di depan nama gula sederhana. Bentuk lmerupakan bayangan cermin dari bentuk d. Bila gugus hidroksil pada karbon nomor 2 (di tengah) dari sebuah molekul struktur linier gliseraldehida terletak di sebelah kanan, dinamakan d dan bila berada di sebelah kiri, dinamakan l .
Perhatikan contoh berikut.
Secara umum dapat dituliskan seperti berikut.
Contoh :
Meskipun terdapat bentuk d dan l , tetapi monosakarida-monosakarida yang terdapat di alam pada umumnya berbentuk d, dan jarang sekali dalam bentuk l , kecuali l-fruktosa yang terdapat dalam mukopolisakarida dan mukoprotein. Beberapa pentosa yang secara alam terdapat dalam bentuk l ialah l-arabinosa dan l-xilosa, yang terdapat pada urin penderita pentosuria.
Fischer menggunakan (d) untuk menyatakan konfigurasi (+) gliseraldehida, dengan gugus hidroksil di sebelah kanan; enantiomernya dengan gugus hidroksil di sebelah kiri, ditetapkan sebagai l (-) gliseraldehida. Karbon yang paling teroksidasi (CHO) ditetapkan di bagian atas.
Sebuah ambiguitas serius timbul untuk senyawa seperti asam tartaric aktif. Jika konvensi asam amino yang digunakan, (+) - asam tartarat jatuh di seri D; oleh konvensi gula, ia memiliki konfigurasi L. Salah satu jalan keluar dari dilema ini adalah dengan menggunakan subskrip ss dan gg untuk menunjukkan asam amino atau karbohidrat konvensi, masing-masing. Kemudian konfigurasi mutlak (+) - asam tartrat dapat ditunjuk sebagai salah DSDS - (+) - asam tartrat dari LGLG - (+) - asam tartarat.
C. Pemisahan Campuran Rasemik
Campuran rasemik artinya suatu campuran yang mengandung sepasang enantiomer dalam jumlah yang sama. Sepasang enentiomer itu adalah enantiomer R dan enentiomer S.
Sebagian masyarakat mungkin kurang memperhatikan sifat optis suatu senyawa organik, padahal reaksi kimia dalam sistem biologis makhluk hidup sangat stereospesifik. Artinya suatu stereoisomer akan menjalani reaksi yang berbeda dengan stereoisomer pasangannya dalam sistem biologis makhluk hidup. Bahkan terkadang suatu stereoisomer akan menghasilkan produk yang berbeda dengan stereoisomer pasangannya dalam sistem biologis makhluk hidup.
Dalam kebanyakan reaksi di laboratorium, seorang ahli kimia menggunakan bahan baku akiral ataupun rasemik dan memperoleh produk akiral dan rasemik. Oleh karena itu sering kiralitas (atau tiadanya kiralitas) pereaksi dan produk diabaikan dalam bab-bab berikutnya
Campuran rasemik artinya suatu campuran yang mengandung sepasang enantiomer dalam jumlah yang sama. Sepasang enantiomer adalah enantiomer R dan enantiomer S. Sebagian masyarakat mungkin kurang memperhatikan sifat optis suatu senyawa organik, padahal reaksi kimia dalam sistem biologis makhluk hidup sangan stereospesifik. Artinya suatu stereoisomer akan menjalani reaksi berbeda dengan stereoisomer pasangannya dalam sistem biologis makhluk hidup. Bahkan terkadang suatu stereoisomer akan menghasilkan produk yang berbeda stereoisomer pasangannya dalam sistem biologis makhluk hidup.
Berlawanan dengan reaksi kimia di laboratorium, kebanyakan reaksi biologis mulai dengan pereaksi kiral atau akiral dan menghasilkan produk-produk kiral. Reaksi biologis ini dimungkinkan leh katalis biologis yang disebut enzim, yang bersifat kiral. Karena enzim bersifat kiral, maka enzim dapat sangat selektif dalam keguatan katalitiknya. Dalam laboratorium pemisahan fisis suatu campuran rasemik menjadi enantiomer- enantiomer murni disebut resolusi campuran rasemik itu. Pemisahan natrium amonium tartarat rasemik oleh Pasteur adalah suatu resolusi campuran tersebut. Enantiomer- enantiomer yang mengkristal secara terpisah merupakan gejala yang sangat jarang, jadi cara Pasteur tidak dapat dianggap sebagai suatu teknik yang umum. Karena sepasang enantiomer itu menunjukkan sifat-sifat fisika dan kimia yang sama, maka tidak dapat dipisahkan.
Suatu cara untuk memisahkan campuran rasemik atau sekurangnya mengisolasi enantiomer murni adalah mengolah campuran itu dengan suatu mikroorganisme yang hanya akan mencerna salah satu dari enantiomer itu. Misalnya (R)- nikotina murni dapat diperoleh dari (R)(S)- nikotina dengan menginkubasi campuram rasemik itu dengan bakteri Pseudomonas Putida yang mengoksidasi (S)- nikotina tetapi tidak (R)-enantiomer.
Suatu cara untuk memisahkan campuran rasemik atau sekurangnya mengisolasi enantiomer murni adalah mengolah campuran itu dengan suatu mikroorganisme yang hanya akan mencerna salah satu dari enantiomer itu. Misalnya (R)- nikotina murni dapat diperoleh dari (R)(S)- nikotina dengan menginkubasi campuram rasemik itu dengan bakteri Pseudomonas Putida yang mengoksidasi (S)- nikotina tetapi tidak (R)-enantiomer.
permasalahan : bagaiman cara untuk memisahkan campuran rasemik atau sekurangnya mengisolasi enantiomer murni? dan jelaskan bagaimana proyeksi fischer ? terimakasih